โดยรวมหลากหลายโซลูชั่นภายใต้พอร์ทโฟลิโออัลตร้าซาวด์ของฟิลิปส์ รวมถึงอัลตร้าซาวด์แบบจัดการทางไกล (Lumify with Reacts) จึงช่วยให้บุคลากรทางการแพทย์สามารถวินิจฉัยโรคได้อย่างมีประสิทธิภาพ
 รอยัล ฟิลิปส์ ผู้นำด้านเทคโนโลยีเพื่อการดูแลสุขภาพ ได้รับการอนุมัติจากองค์การอาหารและยาแห่งสหรัฐอเมริกา (U.S. Food and Drug Administration – FDA) ว่าด้วยเรื่องการอนุญาตให้สามารถใช้อัลตร้าซาวด์ของฟิลิปส์ในการวินิจฉัยและติดตามอาการของผู้ป่วยโควิด-19 ที่มีอาการทางปอดและหัวใจได้ โดยอัลตร้าซาวด์แบบมือถือและพกพาของฟิลิปส์นั้นได้กลายเป็นตัวช่วยสำคัญสำหรับบุคลากรทางการแพทย์ในการจัดการกับผู้ป่วยโรคโควิด-19 เนื่องจากให้คุณภาพของภาพจากการตรวจที่ดี สะดวกในการพกพาไปตรวจผู้ป่วย และสามารถทำความสะอาดฆ่าเชื้อได้อย่างง่ายดาย ซึ่งการอนุมัติในครั้งนี้ถือเป็นครั้งแรกของวงการ ดังนั้น เพื่อเป็นการสนับสนุนการทำงานของบุคลากรทางการแพทย์ ฟิลิปส์จึงได้รวบรวมข้อมูลและแนวทางในการจัดการผู้ป่วยโควิด-19 โดยใช้อัลตร้าซาวด์ฟิลิปส์ไว้ตามลิ้งก์นี้ detailed, practical guidance สำหรับโซลูชั่นอัลตร้าซาวด์ของฟิลิปส์ที่ได้รับการอนุมัติจาก U.S. FDA ให้ใช้กับผู้ป่วยโควิด-19 ประกอบด้วย อัลตร้าซาวด์รุ่น EPIQ, Affiniti, Lumify, CX50, Sparq รวมถึงระบบวัดและคำนวณอย่าง QLAB Advanced Quantification Software ด้วย
รอยัล ฟิลิปส์ ผู้นำด้านเทคโนโลยีเพื่อการดูแลสุขภาพ ได้รับการอนุมัติจากองค์การอาหารและยาแห่งสหรัฐอเมริกา (U.S. Food and Drug Administration – FDA) ว่าด้วยเรื่องการอนุญาตให้สามารถใช้อัลตร้าซาวด์ของฟิลิปส์ในการวินิจฉัยและติดตามอาการของผู้ป่วยโควิด-19 ที่มีอาการทางปอดและหัวใจได้ โดยอัลตร้าซาวด์แบบมือถือและพกพาของฟิลิปส์นั้นได้กลายเป็นตัวช่วยสำคัญสำหรับบุคลากรทางการแพทย์ในการจัดการกับผู้ป่วยโรคโควิด-19 เนื่องจากให้คุณภาพของภาพจากการตรวจที่ดี สะดวกในการพกพาไปตรวจผู้ป่วย และสามารถทำความสะอาดฆ่าเชื้อได้อย่างง่ายดาย ซึ่งการอนุมัติในครั้งนี้ถือเป็นครั้งแรกของวงการ ดังนั้น เพื่อเป็นการสนับสนุนการทำงานของบุคลากรทางการแพทย์ ฟิลิปส์จึงได้รวบรวมข้อมูลและแนวทางในการจัดการผู้ป่วยโควิด-19 โดยใช้อัลตร้าซาวด์ฟิลิปส์ไว้ตามลิ้งก์นี้ detailed, practical guidance สำหรับโซลูชั่นอัลตร้าซาวด์ของฟิลิปส์ที่ได้รับการอนุมัติจาก U.S. FDA ให้ใช้กับผู้ป่วยโควิด-19 ประกอบด้วย อัลตร้าซาวด์รุ่น EPIQ, Affiniti, Lumify, CX50, Sparq รวมถึงระบบวัดและคำนวณอย่าง QLAB Advanced Quantification Software ด้วย
อัลตร้าซาวด์ได้รับการพิสูจน์แล้วว่า สามารถใช้ในการตรวจเนื้อเยื่อปอดของผู้ป่วยปอดอักเสบติดเชื้อได้ ซึ่งเป็นอาการเด่นชัดของผู้ที่ติดเชื้อโควิด-19 นอกจากนี้ ผู้ป่วยโควิด-19 ส่วนมากจะมีปัญหาเกี่ยวกับระบบทางเดินหายใจ จึงอาจจะมีผลทำให้หัวใจทำงานผิดปกติ เสี่ยงต่อการเกิดภาวะแทรกซ้อนที่หัวใจได้ การตรวจวินิจฉัยด้วยอัลตร้าซาวด์ จึงสามารถช่วยประเมินได้ว่าผู้ป่วยจะมีภาวะเสี่ยงต่อการเกิดโรคแทรกซ้อนที่หัวใจหรือไม่ นอกจากนี้ การใช้เครื่องอัลตร้าซาวด์ยังสามารถช่วยลดโอกาสการแพร่เชื้อไวรัสไปยังผู้ป่วยคนอื่นหรือบุคลากรทางการแพทย์ในโรงพยาบาลได้ เนื่องจากสามารถทำการตรวจติดตามอาการของผู้ป่วยโควิด-19 ณ จุดที่รักษาโดยไม่ต้องเคลื่อนย้ายผู้ป่วยไปมาในโรงพยาบาล
บิค เลอ รองประธานอาวุโสและผู้จัดการใหญ่ กลุ่มธุรกิจอัลตร้าซาวด์ของฟิลิปส์ กล่าวว่า “บุคลากรทางการแพทย์หลายท่านได้บอกเราว่า อัลตร้าซาวด์แบบพกพาเป็นเครื่องมือสำคัญในการต่อสู้กับการแพร่ระบาดโควิด-19 ครั้งนี้ โดยทางฟิลิปส์ได้มีการเผยแพร่แนวทางและคำแนะนำในการใช้อัลตร้าซาวด์เพื่อจัดการเกี่ยวกับโรคปอดและหัวใจอันเกิดจากโควิด-19 อย่างปลอดภัยและมีประสิทธิภาพ ซึ่งตอนนี้ฟิลิปส์ได้ทำการเพิ่มกำลังการผลิตเครื่องมือแพทย์รวมถึงเครื่องอัลตร้าซาวด์เพื่อรองรับการใช้งานของบุคลากรทางแพทย์ทั่วโลก”
ฟิลิปส์ ในฐานะผู้นำด้านเทคโนโลยีเครื่องมือแพทย์และอัลตร้าซาวด์ด้านหัวใจ รวมถึงความโดดเด่นของโซลูชั่น อัลตร้าซาวด์แบบพกพาและทางไกล Lumify with Reacts handheld tele-ultrasound solution ทำให้ฟิลิปส์สามารถนำเสนอนวัตกรรมเพื่อช่วยสนับสนุนการทำงานของบุคลากรด้านสาธารณสุขในการต่อสู้กับโรคระบาดใหญ่ครั้งนี้ได้ โดยเฉพาะโซลูชั่น Lumify with Reacts ซึ่งเป็นเครื่องอัลตร้าซาวด์แบบพกพาที่สามารถเชื่อมต่อเข้ากับสมาร์ทโฟนหรือแทบเล็ตได้ จึงสะดวกในการเคลื่อนย้ายไปยังจุดที่รักษาผู้ป่วย และยังเป็นอัลตร้าซาวด์แบบพกพาเครื่องแรกของโลกที่มีเทคโนโลยีเพื่อการรักษาทางไกล ด้วยการเชื่อมต่อกับแพลทฟอร์ม Reacts ระบบการสื่อสารทั้งภาพและเสียงแบบสองทาง จึงสามารถแสดงภาพอัลตร้าซาวด์แบบเรียลไทม์ ทำให้ทั้งผู้ที่ทำการตรวจผู้ป่วย ณ จุดตรวจและผู้ที่วินิจฉัยอยู่อีกที่หนึ่ง สามารถเห็นภาพอัลตร้าซาวด์และตำแหน่งตรวจได้พร้อมกัน พร้อมทั้ง สามารถสื่อสารกันได้ทันที โซลูชั่นนี้จึงเข้ามาช่วยลดความเสี่ยงด้านการติดเชื้อให้บุคลากรทางการแพทย์ในช่วงวิกฤตโควิด-19 นี้
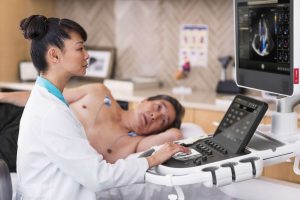
ด้านนายวิโรจน์ วิทยาเวโรจน์ ประธานและกรรมการผู้จัดการ บริษัท ฟิลิปส์ (ประเทศไทย) จำกัด กล่าวว่า “การได้รับอนุมัติจากองค์การอาหารและยาแห่งสหรัฐอเมริกา เพื่อนำโซลูชั่นอัลตร้าซาวด์ของฟิลิปส์ไปใช้ในการจัดการผู้ป่วยโควิด-19 ในครั้งนี้ ต้องถือว่าเป็นเรื่องที่น่ายินดีอย่างยิ่ง เพราะเห็นถึงการทำงานร่วมกันอย่างแข็งขันของทั้งภาครัฐและภาคเอกชนในการฝ่าวิกฤติในครั้งนี้ ซึ่งโซลูชั่นอัลตร้าซาวด์ของฟิลิปส์ ต้องถือว่ามีคุณสมบัติโดดเด่น มีฟีเจอร์และฟังก์ชั่นการใช้งานที่สามารถตรวจและติดตามอาการเกี่ยวกับปอดและหัวใจได้อย่างมีประสิทธิภาพ อาทิ EPIQ CVx ระบบอัลตร้าซาวด์ด้านหัวใจระดับพรีเมี่ยม ที่สามารถแสดงผลภาพหัวใจสองมิติแบบอัตโนมัติ และสามารถแสดงผลสามมิติของปริมาตรหัวใจห้องล่างขวาและการวัดการบีบตัวของหัวใจได้อย่างแม่นยำ สำหรับฟิลิปส์ ในประเทศไทย เราได้นำเสนอนวัตกรรมและโซลูชั่นต่างๆ เพื่อสนับสนุนการทำงานของบุคลากรทางการแพทย์ให้ได้มากที่สุด โดยนอกจากเราจะนำเสนอนวัตกรรมแล้ว เรายังจำเป็นต้องให้การบริการอย่างเต็มที่ด้วย เราก็หวังว่าเราจะเป็นส่วนหนึ่งในการช่วยเหลือบุคลากรทางการแพทย์เพื่อการดูแลและรักษาผู้ป่วยอย่างมีประสิทธิภาพ”
สำหรับผู้ที่สนใจสามารถติดตามรายละเอียดเพิ่มเติมเกี่ยวกับโซลูชั่น Philips Ultrasound ได้ที่ลิ้งก์ผลิตภัณฑ์
- EPIQ series
- Affiniti series
- Lumify
- CX50
- Sparq diagnostic ultrasound systems
- QLAB Advanced Quantification Software
ติดตามข่าวสารเกี่ยวกับฟิลิปส์และการร่วมสู้กับโควิด-19 ได้ที่ https://www.philips.com/a-w/about/news/home
Philips receives FDA clearance for the use of its ultrasound portfolio to manage COVID-19-related lung and cardiac complications
Philips’ ultrasound portfolio, including Lumify with Reacts handheld tele-ultrasound solution, provides valuable diagnostic insight for front-line care providers
Bangkok, Thailand – Royal Philips (NYSE: PHG, AEX: PHIA), a global leader in health technology, today announced that it has received 510(k) clearance from the U.S. Food and Drug Administration (FDA) to market a wide range of its ultrasound solutions for the management of COVID-19-related lung and cardiac complications. Handheld and portable ultrasound solutions in particular have become valuable tools for clinicians treating COVID-19 patients due to their imaging capabilities, portability and ease of disinfection. As a result of this regulatory clearance, which is an industry first, Philips can provide detailed, practical guidance to support clinicians using its systems and software for patients affected by COVID-19. The clearance applies to Philips ultrasound systems including the EPIQ series, Affiniti series, Lumify, CX50 and Sparq diagnostic ultrasound systems, and to off-cart solutions like QLAB Advanced Quantification Software.
Ultrasound has shown value in imaging peripheral lung tissue affected by pneumonia, which is closely tied to COVID-19 lung complications. As respiratory strain can also lead to cardiac dysfunction, COVID-19 patients are at increased risk for cardiac complications. A cardiac ultrasound exam can help in evaluating the effects that disease progression may have on heart function. By imaging COVID-19 patients at the point of care, such as in the Emergency Department (ED) or Intensive Care Unit (ICU), clinicians can diagnose and monitor patients without the need to move them around the hospital, helping to reduce the risk of virus transmission to other patients or to healthcare professionals.
“Many healthcare providers have told us that our handheld and portable ultrasound solutions are playing a valuable role in their efforts to combat COVID-19,” said Bich Le, Senior Vice President and General Manager Ultrasound at Philips. “With this regulatory clearance we can offer clear guidance to ensure safe and effective use of ultrasound to manage COVID-19-related lung and cardiac complications. At the same time, we are investing significantly to ramp up production globally, including at our ultrasound manufacturing plants in the US.”
With its broad portfolio, leadership in areas including cardiac ultrasound and the unique capabilities of the Lumify with Reacts handheld tele-ultrasound solution, Philips is well positioned to support healthcare providers with ultrasound solutions as they combat the pandemic. The Lumify with Reacts point-of-care ultrasound solution, which works in conjunction with a compatible smartphone or tablet, is the world’s first ultra-portable ultrasound device with advanced telehealth capabilities. The Reacts communications platform enables two-way audio-visual calls with live ultrasound streaming, so both parties can simultaneously view the live ultrasound image and probe positioning, while discussing and interacting at the same time. In the context of COVID-19, this solution can help minimize the risk of virus transmission for the medical team.
The new guidance highlights the specific presets, transducers, quantification tools and other capabilities available on Philips’ ultrasound systems that are relevant in assessing and managing COVID-19-related lung and cardiac complications. For example, the EPIQ CVx premium cardiology ultrasound system includes automated applications for 2D assessment of the heart, as well as robust 3D right ventricle volume and ejection fraction measurements.
The regulatory clearance includes the following Philips ultrasound systems: EPIQ series, Affiniti series, Lumify, CX50, and Sparq diagnostic ultrasound systems and off-cart solutions like QLAB Advanced Quantification Software. More information on how Philips is responding to COVID-19 can be found on the company’s global newscenter.
For further information, please contact:
Chadajit Polsuppanich
Communications Manager at Philips Thailand
Tel: +66 65 508 7929
Email: chadajit.polsuppanich@philips.com
About Royal Philips
Royal Philips (NYSE: PHG, AEX: PHIA) is a leading health technology company focused on improving people’s health and enabling better outcomes across the health continuum from healthy living and prevention, to diagnosis, treatment and home care. Philips leverages advanced technology and deep clinical and consumer insights to deliver integrated solutions. Headquartered in the Netherlands, the company is a leader in diagnostic imaging, image-guided therapy, patient monitoring and health informatics, as well as in consumer health and home care. Philips generated 2019 sales of EUR 19.5 billion and employs approximately 81,000 employees with sales and services in more than 100 countries. News about Philips can be found at www.philips.com/newscenter.


































































